隨著國(guó)內(nèi)醫(yī)療水平的不斷提升,高端進(jìn)口醫(yī)療器械的需求量與日俱增。醫(yī)療器械作為直接或者間接用于人體的儀器、設(shè)備、器具,與人們的生命健康安全息息相關(guān),其生產(chǎn)、經(jīng)營(yíng)、使用有嚴(yán)格的管理制度,各類醫(yī)療器械進(jìn)口商在進(jìn)口時(shí)需嚴(yán)格按照相關(guān)要求進(jìn)行申報(bào)。因此,醫(yī)療器械進(jìn)口商及使用者特別需要注意醫(yī)療器械的備案與注冊(cè)、中文標(biāo)識(shí)及說明書、入境檢驗(yàn)檢疫等問題。
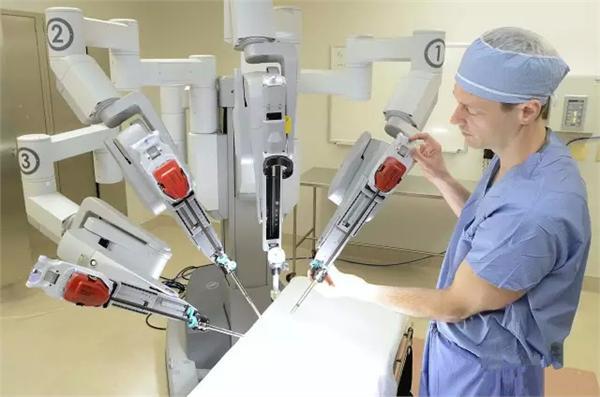
一、醫(yī)療器械備案和注冊(cè)問題。隨著進(jìn)出口貿(mào)易的不斷深入,越來越多的企業(yè)開始從事進(jìn)口醫(yī)療器械的經(jīng)營(yíng),但部分企業(yè)卻對(duì)產(chǎn)品的備案和注冊(cè)不甚了解,因此,國(guó)內(nèi)醫(yī)療器械監(jiān)督管理?xiàng)l例對(duì)進(jìn)口醫(yī)療器械備案和注冊(cè)進(jìn)行了說明,其中向我國(guó)境內(nèi)出口第一類醫(yī)療器械的境外生產(chǎn)企業(yè),由其在我國(guó)境內(nèi)設(shè)立的代表機(jī)構(gòu)或者指定我國(guó)境內(nèi)的企業(yè)法人作為代理人,向國(guó)務(wù)院食品藥品監(jiān)督管理部門提交備案資料和備案人所在國(guó)(地區(qū))主管部門準(zhǔn)許該醫(yī)療器械上市銷售的證明文件。
向我國(guó)境內(nèi)出口第二類、第三類醫(yī)療器械的境外生產(chǎn)企業(yè),應(yīng)當(dāng)由其在我國(guó)境內(nèi)設(shè)立的代表機(jī)構(gòu)或者指定我國(guó)境內(nèi)的企業(yè)法人作為代理人,向國(guó)務(wù)院食品藥品監(jiān)督管理部門提交注冊(cè)申請(qǐng)資料和注冊(cè)申請(qǐng)人所在國(guó)(地區(qū))主管部門準(zhǔn)許該醫(yī)療器械上市銷售的證明文件。
二、中文標(biāo)識(shí)及說明書問題。從以往的進(jìn)口檢驗(yàn)監(jiān)管案例中可發(fā)現(xiàn),進(jìn)口醫(yī)療器械主要產(chǎn)品標(biāo)識(shí)標(biāo)志和中文說明書不符合規(guī)定的情況較多。根據(jù)國(guó)內(nèi)醫(yī)療器械監(jiān)督管理?xiàng)l例的規(guī)定,進(jìn)口的醫(yī)療器械應(yīng)當(dāng)有中文說明書、中文標(biāo)簽,說明書、標(biāo)簽應(yīng)當(dāng)符合本條例規(guī)定以及相關(guān)強(qiáng)制性標(biāo)準(zhǔn)的要求,并在說明書中載明醫(yī)療器械的原產(chǎn)地以及代理人的名稱、地址、聯(lián)系方式。沒有中文說明書、中文標(biāo)簽或者說明書、標(biāo)簽不符合本條規(guī)定的,不得進(jìn)口。因此,進(jìn)口商在產(chǎn)品進(jìn)口前應(yīng)及時(shí)更換中文標(biāo)識(shí),配上相應(yīng)的中文說明書。





 全部商品分類
全部商品分類













